Storia strumentale e chirurgia del freddo.
di Leopoldo Avalle
Introduzione.
La criochirurgia è una disciplina chirurgica, attuale e in rapido sviluppo, le cui origini si perdono nel tempo. Già 3000 anni prima di Cristo, l’Edwin Smith Papyrus, il testo medico più antico finora conosciuto, datato 3500 a. C., fa numerose referenze all’uso del freddo come terapia.
Il grande medico e studioso Ippocrate evidenziò gli effetti negativi del freddo sugli abitanti delle terre con climi gelidi. Di contro, notò anche le conseguenze benefiche dello stesso per controllare l’emorragia e ridurre il gonfiore specifico delle articolazioni doloranti [ 3 ].
La scuola ippocratica di medicina usò il raffreddamento totale del corpo per il trattamento del tetano [ 66 ].
Parimenti i medici di Annibale e di Alessandro Magno, in taluni casi, immergevano i loro malati in bagni freddi com’era anche solito fare il famoso chirurgo cinese Hua To (200 d. C.) immergendo di routine a forza il suo paziente nudo e febbricitante in un recipiente di pietra [ 66 ].
Quasi cinque secoli dopo, l’anestesia dovuta al freddo era conosciuta dai medici italiani [ 4 ].
Barron de Larrey, un chirurgo dell’esercito francese durante la campagna napoleonica in Russia, utilizzando neve e ghiaccio, raffreddava le parti che dovevano subire amputazione per rendere la procedura priva di dolore [ 5 ].
Queste informazioni sono puramente descrittive e, se non facciamo uno sforzo di fantasia, non ci affiora alla mente alcun "dispositivo strumentale" che possa essere stato utilizzato nei tempi passati.
Scrive giustamente il prof. Korpan:
"Un controllo della storia della criochirurgia mostrerà che è progredita a salti e che ogni salto di solito è stato attivato dall’innovazione tecnologica che immediatamente l’ha preceduta. "
Ed è proprio l’evoluzione strumentale, di cui si serve la criochirurgia, che è evoluta a "salti" perché il progredire della fisica e della scienza in generale si sviluppa esplodendo dopo una relativa fase di stasi.
Possiamo affermare che grazie alla scoperta del termometro inventato da Fahrenheit nel 1714 e reinventato da Reaumur e Celsius che la criochirurgia si dota di un vero strumento "scientifico".
E’ da questa la data che, secondo noi, finisce il ciclo di utilizzo della criochirurgia come metodo empirico che abbiamo definito riguardo alla parte strumentale come "Strumentazione criochirurgica ARCAICA".
Finisce il periodo della strumentazione criochirurgica arcaica e nasce quello della "strumentazione criochirurgica TECNICA".
Nel 1961, Irving Cooper sviluppò il primo sistema chiuso a criosonde ed entrò nella moderna era della chirurgia criogenica. Inizia pertanto il periodo che noi definiamo come quello della "strumentazione criochirurgica MODERNA" dando fine al periodo della criochirurgia tecnica.
Questo intervallo si protrae sino ai nostri giorni con vicende alterne di periodi di successi e lunghe stasi di quasi piatta inattività (almeno dal punto di vista creazioni di nuove metodologie strumentali).
Riteniamo che dal 2015 inizierà la fase concernente la strumentazione criochirurgica FUTURA.
In base alle precedenti classificazioni imposteremo la nostra ricerca sugli sviluppi della strumentazione criochirurgica e precisamente:
1 – periodo arcaico della strumentazione criochirurgica.
2 – periodo tecnico della strumentazione criochirurgica.
3 – periodo moderno della strumentazione criochirurgica.
4 – futuro della strumentazione criochirurgica.
Facciamo notare che la suddivisione temporale dello sviluppo della strumentazione criochirurgica da noi adottata è fondata su concetti puramente arbitrari.
Il grado Fahrenheit è l’unità di una scala di misura della temperatura così chiamata in onore del fisico tedesco Gabriel Fahrenheit.
PERIODO ARCAICO DELLA STRUMENTAZIONE CRIOCHIRURICA.
Sia i greci sia gli antichi egizi solevano applicare compresse fredde su ferite o traumi cranici per curare o per lenire il dolore.
Ippocrate curava il tetano immergendo il paziente in un bagno gelido. Ricordiamo che i medici di Annibale e di Alessandro Magno, talora, sottoponevano a un bagno gelido i loro malati com’era uso fare il famoso chirurgo cinese Hua Tt nel 200 d. C.
Ricordiamo che i medici di Annibale e di Alessandro Magno, talora, sottoponevano a un bagno gelido i loro malati com’era uso fare il famoso chirurgo cinese Hua Tt nel 200 d. C.
Abbiamo incontrato in precedenza il chirurgo napoleonico Barron de Larrey, che durante la campagna militare in Russia, utilizzava impacchi di neve e ghiaccio, per raffreddare le parti che dovevano subire amputazione. Questotrattamento rendeva la procedura priva di dolore (o quasi).
Potremo continuare con questi esempi di applicazioni antiche dell’uso del freddo ma non riusciamo a trovare, come strumentazione chirurgica, che panni o bende raffreddate con neve o ghiaccio ma non vi era alcuna macchina in grado di produrre il freddo.
Era utilizzato il ghiaccio prodotto dalla natura o impacchi di neve.
In taluni casi il paziente era costretto a immergersi in bagni gelidi o sottoporsi a docce fredde.
Sapendo leggere tra le righe, con ogni probabilità, i medici cercarono di procurarsi il freddo in ogni modo e questa loro ricerca avrebbe potuto essere stimolo a fisici o ingegneri. Queste, però, sono solo ipotesi che formuliamo senza alcun riferimento storico.
La seguente immagine, nella sua ironia, svela molte verità che a un attento osservatore sono più eloquenti di molte parole.
Non vi sono strumenti che indichino la temperatura del paziente o quella del bagno. L’igiene non è propriamente quella che i medici dei nostri giorni avrebbero permesso. E lo stato del paziente potrebbe essere discutibile per il trattamento che riceve.
E’ l’invenzione del termometro che permetterà ai medici di fare valutazioni e apportare modifiche ai sistemi che loro utilizzano. Con questo strumento finisce l’era della strumentazione criochirurgica arcaica e inizia quella tecnica.
PERIODO TECNICO DELLA STRUMENTAZIONE CRIOCHIRURICA.
James Arnott
 James Arnott (1797-1883) tra il 1845 e il 1851, un medico inglese di Brighton (Figura B), è stata la prima persona a utilizzare il freddo estremo a livello locale per la distruzione dei tessuti. Nel 1845, ha descritto l’uso di soluzioni saline ghiacciate (circa -20°C) per congelare tumori avanzati in siti accessibili, con conseguente riduzione del volume del tumore e miglioramento delle emorragie e del dolore locale [ 8 ] [Bird, 1949]. I tumori trattati da Arnott utilizzando la tecnica di congelamento incluso il cancro della mammella, il cancro uterino, e alcuni tumori della pelle. Anche se palliativo era l’obiettivo principale, egli ha riconosciuto il potenziale del freddo per la cura del cancro. Ha sostenuto il trattamento con basse temperature per l’acne, nevralgie, mal di testa, raggiungendo una temperatura di -24°C. Ha inoltre progettato un apparecchio per l’applicazione del freddo negli interventi chirurgici, strumento che è stato presentato alla Grande Esposizione di Londra nel 1851 [ 3 ].
James Arnott (1797-1883) tra il 1845 e il 1851, un medico inglese di Brighton (Figura B), è stata la prima persona a utilizzare il freddo estremo a livello locale per la distruzione dei tessuti. Nel 1845, ha descritto l’uso di soluzioni saline ghiacciate (circa -20°C) per congelare tumori avanzati in siti accessibili, con conseguente riduzione del volume del tumore e miglioramento delle emorragie e del dolore locale [ 8 ] [Bird, 1949]. I tumori trattati da Arnott utilizzando la tecnica di congelamento incluso il cancro della mammella, il cancro uterino, e alcuni tumori della pelle. Anche se palliativo era l’obiettivo principale, egli ha riconosciuto il potenziale del freddo per la cura del cancro. Ha sostenuto il trattamento con basse temperature per l’acne, nevralgie, mal di testa, raggiungendo una temperatura di -24°C. Ha inoltre progettato un apparecchio per l’applicazione del freddo negli interventi chirurgici, strumento che è stato presentato alla Grande Esposizione di Londra nel 1851 [ 3 ].
La vigilia di Natale del 1877, Cailletet, francese, e Picet, Svizzero, hanno [1878] dimostrato presso l’Accademia Francese delle Scienze che ossigeno e monossido di carbonio possono essere liquefatti sotto pressione elevata. L’anno seguente, 1878, Pictet [1878] ha documentato anche la liquefazione dell’ossigeno, utilizzando una refrigerazione in cascata meccanica. Nel 1895, fu la prima volta che Carl von Linde, tedesco, riuscì a liquefare l’aria comprimendola e poi lasciandola espandere rapidamente, e così che ha prodotto l’aria liquida commerciale. Egli ha promosso la sua diffusione in Europa e negli Stati Uniti. (1895 – 1896)
Nel 1898, il professor Charles E. Tripler della Columbia University ha realizzato un metodo utilizzante aria liquida, e convinse il dermatologo di New York, il Dr. A. Campbell White a servirsi di questo criogeno nel trattamento delle lesioni cutanee.
La prima applicazione clinica dell’aria liquida (-190°C) è avvenuta nel 1889 per opera di un medico di New York City, Campbell White, che ha usato un tampone, uno spray, o un dispositivo a rullo in ottone. La prima pubblicazione del Dr. White aveva come titolo “Aria Liquida in Medicina e Chirurgia”, ed è apparso sul The Medical Record, il 22 luglio [ 9 ].
Sono state usate diverse tecniche. Le due più frequentemente utilizzate erano il metodo a “tampone” e quello “spray”. Il “tampone” consisteva in una piccola quantità di cotone idrofilo avvolto intorno all’estremità di un bastone di legno che avrebbe potuto essere a punta, piatta, rotonda, o a forma di pagaia sulla misura della lesione da trattare. Questo era immerso nell’aria liquida e applicato alla lesione cutanea.
Lo spray è ottenuto inserendo un particolare turacciolo di gomma perforato contenente due tubi di vetro in un ordinario contenitore di lavaggio, e chiudendo con un dito la bocca del tubo d’ingresso (Fig. C).
Il metodo spray è stato usato topicamente per analgesia e nel trattamento di disordini dermatologici come l’”edera velenosa”, dermatiti, herpes zoster, foruncoli, carbonchi, lupus vulgaris, e lupus eritematoso.
Il Dr. White ha eseguito un esperimento controllato nel trattamento della dermatite edera velenosa: “Una fascia intorno all’avambraccio circa tre centimetri di larghezza è stata leggermente congelata con lo spray, poi il trattamento è stato applicato all’intera superficie avvelenata compresa la parte che era stata trattata con l’aria nella successiva medicazione”.
Quando il dito è posto sopra l’uscita dell’aria, la pressione prodotta dall’ebollizione del liquido interno al Dewar spinge il contenuto a uscire attraverso il tubo di vetro lungo.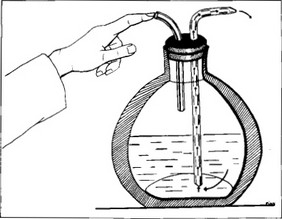 L’anidride carbonica solidificata (-78,5 ° C) è stata introdotta nella pratica clinica da parte del Dr. William Pusey di Chicago. Il quale ha favorito l’utilizzo del biossido di carbonio solido, che era comunemente impiegato come refrigerante. Egli ha trattato, nevi vascolari, lupus eritematosi, lupus vulgaris, ed epiteliomi [10].
L’anidride carbonica solidificata (-78,5 ° C) è stata introdotta nella pratica clinica da parte del Dr. William Pusey di Chicago. Il quale ha favorito l’utilizzo del biossido di carbonio solido, che era comunemente impiegato come refrigerante. Egli ha trattato, nevi vascolari, lupus eritematosi, lupus vulgaris, ed epiteliomi [10].
Oltre a queste prime notizie, molti medici fecero ricorso alle tecniche di congelamento in dermatologia.
Dopo il 1910, l’aria liquida è stata usata raramente, e l’anidride carbonica solida divenne l’agente criogenico più popolare agli inizi del 1900.
Fine del 19 º secolo: l’uso di aria liquida.
 E’ ancora un medico inglese che ha avuto il merito di “tentare” un approccio strumentale per l’applicazione della criochirurgia. Il suo lavoro è lo sforzo di utilizzare la “tecnologia meccanica” per migliorare l’approccio criochirurgico. I gas (o liquidi criogenici) erano in sostanza pronti e disponibili ai chirurghi ma si utilizzavano tamponi, spray, rulli di ottone, bottiglie a spruzzo o batuffoli di cotone. Parliamo di Hall-Edwards [1913] di Birmingham, Regno Unito, che in primo luogo è conosciuto per il suo collettore compressore del biossido di carbonio realizzato nel 1911.
E’ ancora un medico inglese che ha avuto il merito di “tentare” un approccio strumentale per l’applicazione della criochirurgia. Il suo lavoro è lo sforzo di utilizzare la “tecnologia meccanica” per migliorare l’approccio criochirurgico. I gas (o liquidi criogenici) erano in sostanza pronti e disponibili ai chirurghi ma si utilizzavano tamponi, spray, rulli di ottone, bottiglie a spruzzo o batuffoli di cotone. Parliamo di Hall-Edwards [1913] di Birmingham, Regno Unito, che in primo luogo è conosciuto per il suo collettore compressore del biossido di carbonio realizzato nel 1911.
Nella sua monografia che ha scritto più tardi, nel 1913, ha dettagliato l’uso del biossido di carbonio per il trattamento delle condizioni di molte, in particolare, ulcere dei roditori. Egli ha prospettato l’utilizzo della criochirurgia con l’apporto dei raggi-X. Il suo studio ha portato un grande contributo per la criochirurgia aprendo strade future a metodologie d’indagine che saranno il punto forte di questa scienza negli anni a venire. Allo stesso tempo, Cranston-Low [1911], medico di Edimburgo nel reparto dermatologico, ha confermato, evidenziando in forma sperimentale, che l’uso di neve di anidride carbonica, era efficace nella “ trombosi, danno diretto ai tessuti, e gli essudati infiammatori “ .
Negli anni successivi, la neve di anidride carbonica ha avuto molto successo utilizzata per una varietà di condizioni benigne della pelle ed è rimasta popolare fino al 1960.
Durante questo periodo, sono stati sviluppati diversi dispositivi per l’utilizzo della neve carbonica. Per esempio, Campbell White ha progettato un rullo per il trattamento di erisipela (Rubinsky, 2000) [ 67 ]. Il grande vantaggio dell’aria liquida consisteva nel fatto che era facile, tramite essa, ottenere le basse temperature, permettendo di operare i tumori, ma uno svantaggio è la difficoltà del suo trasporto. Sir James Dewar ha risolto questo problema permettendo il trasporto e lo stoccaggio inventando un contenitore costituito da due pareti di vetro con un vuoto tra esse (Gage, 1998; Rubinsky, 2000) [ 6, 67 ]. Ancora oggi, i contenitori utilizzati per i refrigeranti hanno circa lo stesso design.
Dott. Temple Fay. Parlare di storia della strumentazione criochirurgica non si può omettere di descrivere l’opera di uno tra i grandi che hanno aperto un indicativo paragrafo di questa scienza. L’uomo che per primo ha iniziato come pioniere la “refrigerazione totale” del corpo umano. Chi con il suo coraggio e la sua determinazione ha causato la “rottura della barriera termica”. Con questo termine era menzionato il limite termico in cui si riteneva che un essere umano non potesse sopravvivere. La corrente conoscenza medica prediceva che un paziente sottoposto a un raffreddamento totale inferiore a quello naturale fosse un limite che causava il decesso del paziente stesso. Per questo motivo era chiamata “barriera termica “. Ci riferiamo al Dottor Temple Fay (Fig. E), uno dei più importanti e qualificati neurochirurghi del suo tempo, verso il quale l’Umanità ha un grande debito di riconoscenza. Egli fu un insigne studioso e un encomiabile esempio di correttezza e di coraggio professionale. Fay credeva che la temperatura del corpo sia un importante fattore fisiopatologico in alcune malattie come il cancro. Le scoperte del Dr. Fay hanno portato alle attuali indicazioni terapeutiche e tecniche per ipotermia. Era anche dotato di una tolleranza verso l’incomprensione umana e questo rende ancora più gradevole lo studio della sua vita e delle sue opere.
Parlare di storia della strumentazione criochirurgica non si può omettere di descrivere l’opera di uno tra i grandi che hanno aperto un indicativo paragrafo di questa scienza. L’uomo che per primo ha iniziato come pioniere la “refrigerazione totale” del corpo umano. Chi con il suo coraggio e la sua determinazione ha causato la “rottura della barriera termica”. Con questo termine era menzionato il limite termico in cui si riteneva che un essere umano non potesse sopravvivere. La corrente conoscenza medica prediceva che un paziente sottoposto a un raffreddamento totale inferiore a quello naturale fosse un limite che causava il decesso del paziente stesso. Per questo motivo era chiamata “barriera termica “. Ci riferiamo al Dottor Temple Fay (Fig. E), uno dei più importanti e qualificati neurochirurghi del suo tempo, verso il quale l’Umanità ha un grande debito di riconoscenza. Egli fu un insigne studioso e un encomiabile esempio di correttezza e di coraggio professionale. Fay credeva che la temperatura del corpo sia un importante fattore fisiopatologico in alcune malattie come il cancro. Le scoperte del Dr. Fay hanno portato alle attuali indicazioni terapeutiche e tecniche per ipotermia. Era anche dotato di una tolleranza verso l’incomprensione umana e questo rende ancora più gradevole lo studio della sua vita e delle sue opere.
Le sue infinite domande e sete per la conoscenza l’hanno portato a scoperte in parecchie aree della neurochirurgia e della medicina, alla ricerca di metodi nuovi e innovativi per lo sviluppo della sua scienza [ 15 ].
Nel 1939 i dati concernenti le ricerche di Fay furono presentati al Terzo Congresso sul Cancro, il manoscritto inoltrato in Belgio per la pubblicazione fu confiscato dai Nazisti.
Nei campi di concentramento Nazisti, specialmente Dachau, queste tecniche furono brutalmente applicate senza i benefici dell’anestesia.  L’utilità dell’ipotermia clinica fu pertanto ritardata per decenni: a essa furono associate le atrocità naziste.
L’utilità dell’ipotermia clinica fu pertanto ritardata per decenni: a essa furono associate le atrocità naziste.
Nonostante l’elevato numero di “soggetti umani” a disposizione dei medici nazisti, la scienza dell’ipotermia non registrò alcun progresso. L’umanità subì da questi fatti un periodo di oscuramento scientifico e morale.
La seconda guerra mondiale interruppe il “programma di refrigerazione umana”, Fay spedì la sua strumentazione a Claude Beck e Charles Bailey per aiutare il loro lavoro pionieristico d’ipotermia nella chirurgia cardiaca [ 16 ].
Dopo la seconda guerra mondiale, l’azoto liquido (-196°C) è diventato disponibile in commercio. Nel 1950 questo fluido criogenico è stato introdotto nella pratica clinica dal Dr. Ray Allington.
Il lavoro pionieristico negli anni 50 su una profonda ipotermia totale per la neuro protezione durante le procedure cardiovascolari e neurochirurgiche introdusse l’ipotermia nella pratica neurochirurgica clinica moderna [ 13 -14 ]. Pure nell’anno 1958, il raffreddamento extracorporeo, con una pompa ossigenatrice, fu usato con successo per la chirurgia a cuore aperto [ 12 ]. Quest’intervento è stato pubblicato in occasione della prima Associazione chirurgica del sud, White Sulphur Springs, West Virginia, 10-12 dicembre, 1957.
La necessità di ossigeno diminuisce in ipotermia ciò diventa la base per cui il corpo tollera un’occlusione circolatoria [ 1 ]. Le richieste di ossigeno del corpo in ipotermia possono essere fornite da un semplice ossigenatore extracorporeo con una pompa a bassa portata per ottenere un tempo deliberato d’intervento e un consumo intracardiaco [ 2,3 ].
Discorso che prelude al periodo moderno della strumentazione criochirurgica.
Dall’inizio del secolo 1900 (XIX) sino agli anni 1960 l’evoluzione strumentale della criochirurgia non ebbe un grande sviluppo.
I medici, si limitarono a raffreddare per "contatto" batuffoli di cotone o tele per impacchi, nella migliore delle occasioni, oggetti di rame o di altri metalli.
Il dott. Arnott, eccezionalmente, progettò un apparecchio per l’applicazione del freddo negli interventi chirurgici, strumento che è stato presentato alla Grande Esposizione di Londra nel 1851 [2]. Quest’apparato, a detta dei medici del periodo, era complesso e artificioso. Non ebbe il successo sperato.
Nel frattempo i liquidi criogenici erano in sostanza disponibili, grazie ai lavori di Linde, ai chirurghi ma erano utilizzati con tamponi, spray, rulli di ottone, bottiglie a spruzzo o batuffoli di cotone.
La fisica aveva già trovato le strade per spiegare l’uso di questa tecnica al massimo della sua efficienza (vedi le ricerche di Onnes ) però il mondo della medicina non era ancora pronto.
Dal punto di vista strumentale vi fu un’eccezione, parliamo di Hall-Edwards [1913] di Birmingham, Regno Unito, che realizzò un collettore compressore del biossido di carbonio nel 1911 (Figura D). E’ proprio uno strumento nel senso da noi inteso e, se consideriamo come tali gli apparati di raffreddamento dell’intero corpo realizzati dal Dott Fay (Figura E) i quali avevano la funzione di raffreddare il paziente a temperature comunque sopra lo zero centigrado, non si osservano realizzazioni strumentali degne di nota.
Nei primi anni ’60 la Criochirurgia moderna ebbe inizio attraverso il lavoro collaborativo di un medico, Irving Cooper, e un ingegnere, Arnold Lee [ 18 ].
Questo connubio tra un medico e un ingegnere è stato il fattore vincente che ha aperto la strada alla criochirurgia intesa nel senso attuale del termine.
E’, dunque, grazie al Dott. Cooper e all’Ingegner Lee che la medicina si è arricchita di uno strumento molto efficace aprendo la strada agli interventi moderni nel campo.
E’ una sonda che divenne il prototipo da cui sono stati costruiti e progettati i criodi successivi. Si trattava di una sonda ad azoto liquido.
PERIODO MODERNO DELLA STRUMENTAZIONE CRIOCHIRURGICA.
Irvin Cooper e la chirurgia criogenica.
Nel 1961, il neurochirurgo Irving Cooper (Fig. G) sviluppò un apparato criochirurgico automatizzato che utilizzava l’azoto liquido fatto circolare attraverso una guaina isolata di metallo. Fu il primo sistema a sonda chiusa raffreddato con azoto liquido (-196°C) che fece entrare nell’era moderna la criochirurgia [18]. Sebbene l’apparato sia stato disegnato per produrre una lesione criogenica nel cervello per il trattamento del parkinsonismo, l’interesse nella criochirurgia clinica sbocciò dopo il suo sviluppo.
La criochirurgia cominciò quindi a essere usata per trattare tumori in diversi siti [6]. Nel 1963 seguirono importanti applicazioni della criochirurgia nel trattamento del morbo di Parkinson, Cooper (1963) suggerì che tumori primari e metastatici del fegato potevano essere trattati con la criochirurgia e che il congelamento poteva produrre un effetto immunizzante, anticipando di parecchie decine di anni scoperte biologiche veramente fondamentali. Tra il 1960 e il 1970 furono fatti molti esperimenti di criochirurgia per trattare cellule cancerose, molti dei quali furono eseguiti su vari tipi di animali e in vitro. Cooper osservò che le criolesioni formate erano circoscritte in situ ed erano gradualmente riassorbite dal corpo riducendosi, entro 6-8 settimane dalla procedura, a cicatrici fibrotiche.
Il Dr. Cooper ha aiutato a ripristinare le funzioni muscolari di migliaia di vittime del morbo di Parkinson, attraverso una tecnica chirurgica che ha sviluppato nei primi anni 1950.
La procedura consisteva nel distruggere le minime parti coinvolte del cervello per interrompere l’afflusso di sangue alle cellule che sono state la trasmissione della malattia.
La crioterapia, pertanto, come tecnica terapeutica ricevette un grande stimolo dall’introduzione del primo sistema strumentale criochirurgico in grado di trasportare azoto liquido (-196°C) a sonde tipo la cui asta sottoposta ad alto isolamento permette a una punta di metallo molto conduttiva di raggiungere le basse temperature.
Il sistema era il risultato dello sforzo di collaborazione di Irving S Copper, neurochirurgo, e Arnold Lee, ingegnere [18]. La loro sonda era essenzialmente il prototipo da cui tutte le future sonde criochirurgiche che usano azoto liquido sono state sviluppate [6]. Detto apparato permise ai chirurghi per la prima volta di  trattare lesioni profonde all’interno di organi parenchimali, con traumi minimi al resto dell’organo.
trattare lesioni profonde all’interno di organi parenchimali, con traumi minimi al resto dell’organo.
Lo sviluppo di sonde intraoperatorie e il loro uso per monitorare il processo di congelamento tissutale ravvivarono l’interesse nella criochirurgia negli anni ‘90. Tale risveglio d’interesse fu molto evidente nel trattamento dei cancri prostatico ed epatico con la crioterapia. I rapidi avanzamenti fatti nelle tecniche d’imaging intracranico garantivano in potenziale un riapparire di trattamenti criochirurgici di tumori cerebrali [ 6 ]. Costatiamo che Gage e Collaboratori nel 1982 dimostrarono che i grossi vasi tolleravano il congelamento senza rotture.
La criochirurgia iniziò quindi a essere usata per i tumori della pelle, dei polmoni, della mammella, della prostata, dell’intestino e della faringe. I primi tentativi di distruggere i tumori del fegato utilizzavano l’applicazione diretta di azoto liquido sulla superficie del fegato (Orpwood, 1981; Bischof et al., 1993).
Dott.. Irving S. Cooper, morì di cancro un mercoledì a Neapolis, in Florida. Aveva sessantatré anni e viveva in quella città.
Il dovuto riconoscimento verso questo scienziato, mirabile e geniale, non è mai sufficiente.
Le strade che la sua lodevole intuizione ha aperto incominciano solo ora a essere capite e apprezzate.
Nell’intervallo temporale che fra gli anni 1961 e il 1970, molti studiosi, sulle orme di Cooper, tentarono la costruzione di apparecchi per la criochirurgia utilizzanti vari gas criogenici. Fu provato l’azoto liquido e altri agenti, tra cui l’ossido di azoto, l’anidride carbonica, l’argon, il cloruro di etile, e gli idrocarburi fluorurati [26].
Nel 1965 il dottor Douglas Torre, un insigne dermatologo, si servì dell’apparecchio di Cooper per curare le malattie della pelle. Permise lo sviluppo di un dispositivo spray funzionante ad azoto che era in grado di essere anche utilizzato con criodi di varie forme e dimensioni, convertendo la linea di alimentazione da un condotto aperto verso l’esterno a un sistema chiuso.
I risultati dei trattamenti criochirurgici furono simili a quelli ottenuti con l’apparato ad azoto liquido di Cooper.
Il dottor Torre trattò molti tipi di carcinomi a cellule basali e squamose con la tecnica criochirurgica.
I dermatologi praticano questa scienza da circa settanta anni. In diversi tipi di lesioni cutanee è il trattamento di scelta, e in molti altri, un metodo alternativo di terapia. Si tratta di un metodo semplice, sicuro, veloce, efficace e relativamente indolore il quale offre risultati estetici eccellenti. Grazie alle sue caratteristiche particolari di minor rischio d’infezione ed emorragia, la criochirurgia è ideale nel trattamento di pazienti con aumentato rischio chirurgico, come i diabetici, emofiliaci, o pazienti in terapia con anticoagulanti.
Il Dott. S. Zaccarian A. e MT Adham, [17] nel 1966, prepararono un metodo alternativo poco costoso e semplice da usare. Modellarono dischi di rame di un centimetro di spessore con diametro di superficie 0,5-3 centimetri che potevano essere montati su un manico di plastica. Questi erano immersi in azoto liquido fino a circa -196°C, e applicati alla pelle.
Nel 1967 Setrag Zacarian introdusse un dispositivo manuale di auto-pressurizzazione.
L’anno seguente egli riferisce che l’attività progettuale di un ingegnere, Michael Bryne, ha contribuito alla creazione e allo sviluppo di un dispositivo portatile a spruzzo con azoto liquido.
Dopo alcune modifiche, quest’apparecchio è diventato il primo dispositivo disponibile in commercio della criochirurgia palmare.
Vediamo quindi che, dopo l’esperienza di collaborazione di Cooper con un ingegnere, la creazione di apparati sempre più efficaci e funzionali diventò di uso corrente.
Gonder modificò, quindi, l’apparato di Cooper e fu il primo a usarlo per le malattie alla prostata [20].
Queste pubblicazioni stimolarono un immediato interesse da parte degli urologi e si sviluppò un’intensa esperienza con la criochirurgia prostatica [21-24], includendo, come sopra accennato, un approccio perineale dal glande realizzato da Flocks et al. nel 1972 [25].
Alla fine degli anni 60 molti chirurghi si cimentarono nella criochirurgia prostatica secondo le esperienze e i suggerimenti di Gonder. (Fig. U, Fig. V).
Con la disponibilità di attrezzature criochirurgiche, afferma il Dott. Pope di essere stato in grado di ripetere il lavoro di Gonder e dei suoi associati nella prostata del cane e poi nella prostata dell’uomo.
Verso la fine degli anni ‘60 i chirurghi, almeno quelli americani, riguardo agli interventi di criochirurgia prostatica, abbandonarono la tecnica di Gonder preferendo l’intervento endoscopico utilizzando l’anestesia locale.
E’ l’inizio di un nuovo approccio nella ricerca di metodi sempre più sicuri e generalizzanti che condurrà, dopo varie prove e tentativi, alla criochirurgia prostatica attuale.
CRIOCHIRURGIA ANNI 70 e 80
Nei primi anni del 1970 la criochirurgia subisce un drammatico arresto. L’impossibilità di poter seguire lo sviluppo del fronte freddo nei tessuti sottoposti a trattamento impedisce un’attività sicura e controllata.
Solo la criochirurgia della pelle e quella degli organi accessibili dall’esterno sopravvivevano.
Vi sono poche società di costruzione e progettazione che realizzano prototipi che non hanno conseguentemente futuro commerciale.
Un esempio rappresentativo è la creazione di due strumenti, un oftalmico detto crioestrattore (Fig. H) e l’altro come sonda criochirurgica nominata multicrio (criopencil).
La loro funzione fondamentale era un’alta efficienza operativa e un minimo ingombro. Si potevano trasportare in una comoda valigetta a mano.
 Questi due strumenti, brevettati, furono costruiti a Genova (Italia) grazie alle competenze di tecnici e professori dell’Università di Genova.
Questi due strumenti, brevettati, furono costruiti a Genova (Italia) grazie alle competenze di tecnici e professori dell’Università di Genova.
La praticità operativa e la snellezza d’intervento li rendevano particolarmente efficienti e dotati di caratteristiche le quali, sotto certi aspetti, ancor oggi sarebbero potuti essere apprezzati.
Sempre agli inizi degli anni 1970 precisamente nel Dicembre del 1972 il Dottor R. H. Flocks pubblica sullo Journal of Urology un interessante articolo nel quale descrive un intervento di criochirurgia perineale prostatico. E’, a nostro parere, un successivo passo verso la moderna criochirurgia [25].
L’intervento realizzato presso il Department of urology, University of Iowa Hospitals, Iowa City, Iowa.
I ricercatori, sensibili agli effetti immunizzanti degli interventi di criochirurgia, evidenziano che il Dott. Soanes e collaboratori hanno postulato una crioimmunità perché due pazienti con carcinoma metastatico hanno avuto una regressione in seguito a questo tipo di operazione [19]. Ricerche di laboratorio su autoanticorpi da ghiandole sessuali accessorie di coniglio e vescicole seminali dopo il congelamento hanno sostenuto questa ipotesi [27].
Il Dott. Flock evidenzia che il suo scopo è determinare gli effetti della criochirurgia applicati perinealmente in pazienti con carcinoma prostatico. Informa che i suoi tentativi erano i seguenti:
1) indicare l’efficacia della criochirurgia nel distruggere la lesione locale, mantenendo l’integrità della vescica e dell’uretra adiacente,
2) individuare se la risposta immunitaria era un fenomeno quantitativo in quest’antigene prostatico e verificare se sarebbe stato maggiormente rilasciato per la stimolazione della produzione di autoanticorpi e
3) riconoscere se avviene qualsiasi cambiamento clinico (che è la regressione delle metastasi).
Il dottor Flock da ottimo chirurgo si era proposto un obiettivo di ricerca veramente sensibile, obiettivo che solo dopo parecchi anni d’indagini biologiche è stato in parte chiarito. (vedi nostro capitolo sulla storia della biologia criochirurgica).
Negli anni 1975, 1976 il prof Gage pubblicò due relazioni riguardanti interventi di criochirurgia della pelle.
Il titolo del primo lavoro edito nel settembre 1975 era: "La criochirurgia per i problemi difficili di cancro cutaneo" [33].
L’autore esordisce con queste parole: " questa tecnica terapeutica come il suo avvocato ne difendo proprio i vantaggi che ne giustificano l'impiego in alcuni tumori della pelle ". La criochirurgia ha sviluppato una vasta gamma di utilità nominali. La vasta esperienza di Torre e Zacarian ha mostrano che quasi ogni tipo di cancro della pelle può essere trattato con successo mediante congelamento in situ. Essi hanno mostrano chiaramente il vantaggio della facilità e della semplicità nel trattamento criochirurgico del cancro della pelle comune.
Nell’intervento che il Dott. Gage descrive che sono stati utilizzati apparati criochirurgici usando azoto liquido che può essere gestito sia come un sistema chiuso impiegando criosonde o da un getto di azoto liquido direttamente sul tessuto. Con una criosonda, il metodo è di applicare la criosonda al tumore facendole raggiungere le temperature desiderate.
Il secondo lavoro edito nel 1976 aveva come titolo: "Sopravvivenza a cinque anni dopo la criochirurgia per il cancro orale.".
Sono descritti nell’intervallo che va dal 1964 sino al 1970, l’intervento di sei pazienti selezionati con cancro orale che furono trattati con il freddo in situ con l’intento di curare la malattia.
L’autore evidenzia che gli ultimi risultati dimostrarono la convenienza del metodo applicato per pazienti ad alto rischio e che hanno risaltato la tecnica la quale permetteva, tra gli altri vantaggi, di evitare operazioni di sacrificio e rischio per le ossa.
Statistiche di cinque anni di sopravvivenza hanno mostrato che la criochirurgia è stata usata con maggior successo su tumori di piccole e medie dimensioni senza linfoadenopatie cervicali. I risultati giustificano l’uso continuo della criochirurgia in pazienti attentamente selezionati.
Negli anni 70, dopo una ripresa dell’entusiasmo degli anni precedenti, alcuni usi della criochirurgia caddero in sfavore, altri furono conservati ma con minor importanza, e altri registrati sui libri di testo come tecniche specifiche. Uno dei primi a cadere in disuso fu la criochirurgia per le malattie di Parkinson, che erano state lo stimolo originale di Cooper e dei suoi colleghi. Questo mutamento non fu dovuto al difetto della tecnica. Al contrario negli anni 1963-70, Cooper e i suoi colleghi, S. Stellar a J. Waltz, avevano realizzato una criochirurgia stereotassica dei gangli basali in approssimativamente 8000 pazienti con le caratteristiche di tremore e rigidità del parkinsonismo; i benefici furono accertati nell’85-90% di questi pazienti [28]. Comunque, quando L-dopa venne in uso nel 1968, la criochirurgia stereotassica non era più necessaria nella maggior parte dei casi. Un minimo interesse nel trattamento dei tumori intra craniali e delle anomalie cerebrovascolari non di meno continuò [29,30].
L’impiego della criochirurgia per malattie prostatiche cadde in disuso perché la prolunga del catetere di drenaggio richiede altra operazione, l’incidenza delle complicazioni, e l’efficacia delle resezioni transuretali.
Alcuni interessi persistettero nel trattamento del cancro prostatico a causa del potenziale beneficio forse dovuto alla favorevole risposta immunologica come suggerito dopo la criochirurgia prostatica [31,32]. La competizione del laser ridusse l’uso della criochirurgia delle malattie ginecologiche (cerviciti croniche e neoplasia intra epiteliale cervicale), ma entrambe le tecniche avevano i loro sostenitori. La criochirurgia dermatologica, comunemente usata nei semplici strumenti manuali raffreddati con azoto liquido, divenne in sostanza accettata [33-35].
Le tecniche di criochirurgia divennero di uso comune in oftalmologia per il trattamento di diverse malattie inclusi i tumori [36,37]. L’uso della criochirurgia per le malattie della pelle continuò ad aumentare come dimostra la sponsorizzazione dell’American Accademy of Dermatology in corsi d’insegnamento nei suoi incontri annuali. La criochirurgia nelle neoplasie cervicali intraepiteliali e nelle cerviciti croniche continuò e fu considerata terapia standard, sebbene quella col laser fosse competitiva [38-42].
La criochirurgia per malattia endobronchiale è diventata una tecnica consueta in tutto il mondo.
Il Dott. Sajio Sumida e colleghi [43-47] descrissero i risultati dei trattamenti criomedicali sulla base degli ultimi quaranta anni di esperimenti e clinica. Le osservazioni in vitro e in vivo della formazione di ghiaccio extra e intracellulare e gli insuccessi della microcircolazione dipendenti dalla coagulazione intravascolare disseminata dopo il congelamento in situ sono stati registrati in dettaglio dal Prof. Sumida e collaboratori dal 1970 [48,49].
La criochirurgia per il cancro è aumentata con l’uso combinato della chemioterapia.
In altri settori il progresso era lento. L’uso della criochirurgia per il trattamento delle emorroidi perse i favori a causa della semplicità delle tecniche dell’iniezione (injection) e banding (bendature). I tumori del fegato furono trattati criochirurgicamente, ma non poter visualizzare la profondità delle lesioni permise solo occasionali applicazioni cliniche e da ciò conseguì un beneficio incerto. L’interesse della criochirurgia riguardo al cancro prostatico fu mantenuto in alcuni centri medici ciò si evidenzia in una serie di pubblicazioni da Bonney et al. che dimostrarono un favorevole ritorno come confronto con altre terapie [50,51].
Nel 1988 Torre, Lubritz e Kuflik furono collaboratori di un libro sugli aspetti pratici della criochirurgia in dermatologia [11].
Grazie a questi studiosi n egli ultimi anni, la criochirurgia diventò una consolidata norma di trattamento per un’ampia varietà di lesioni cutanee benigne e maligne, con nuovi usi descritti nella presente relazione.
L’evento più importante che fu il fulcro intorno a cui incominciò ad agire la criochirurgia è stato la scoperta dell’uso degli ultrasuoni (US) nella rilevazione dei fronti freddi negli interventi prostatici.
Questa geniale scoperta è dovuta al Dott Onik che, con due pubblicazioni, un’edita nel 1985 e l’altra tre anni dopo nel 1988, rese evidente e dimostrò l’effetto rivelatore delle onde sonore a frequenza ultrasonica [52-53].
Gli esperimenti furono compiuti su cinque cani e, data la fondamentale importanza e le conseguenze future apportate alla criochirurgia, ci soffermeremo brevemente sui principali dettagli d’immagine.
Il titolo della pubblicazione del 1985 è: "Sonographic monitoring of hepatic cryosurgery in an experimental animal model." (monitoraggio ultrasonico di criochirurgia epatica in un modello sperimentale di animali) [52].
L’autore riferisce che è stata utilizzata l’ecografia in tempo reale per monitorare l'evoluzione in vivo di criolesioni epatiche indotte in quattro cani bastardi.
I risultati suggeriscono che la tecnica ultrasonica è pertanto un efficace e accurato mezzo di monitoraggio dei cicli completi di congelamento e disgelo nella criochirurgia epatica. Il Dott. Onik, ricordava le caratteristiche positive della criochirurgia ma evidenziava che il problema principale nell'applicazione clinica della criochirurgia epatica è la mancanza di un mezzo preciso per monitorare il processo di congelamento. Ora, riferiva, il congelamento è monitorato collocando termocoppie direttamente nel parenchima epatico ai margini del tumore. Ovviamente, questo metodo non consentiva il trattamento dei tumori più profondi, che non possono essere visti dalla superficie epatica. Anche i tumori che sono visibili sulla superficie epatica possono mostrare fallimenti del trattamento, perché i loro margini di profondità all'interno di tessuto normale non si possono pienamente apprezzare da un’ispezione visiva esterna.
Il Dott. Onik, ricordava le caratteristiche positive della criochirurgia ma evidenziava che il problema principale nell'applicazione clinica della criochirurgia epatica è la mancanza di un mezzo preciso per monitorare il processo di congelamento. Ora, riferiva, il congelamento è monitorato collocando termocoppie direttamente nel parenchima epatico ai margini del tumore. Ovviamente, questo metodo non consentiva il trattamento dei tumori più profondi, che non possono essere visti dalla superficie epatica. Anche i tumori che sono visibili sulla superficie epatica possono mostrare fallimenti del trattamento, perché i loro margini di profondità all'interno di tessuto normale non si possono pienamente apprezzare da un’ispezione visiva esterna.
Le ricerche ecografiche in vitro di fegato congelato [7], in combinazione con le moderne tecniche in ecografia intraoperatoria, sono state richieste per indagare la possibilità di fare ricorso a onde sonore ad alta frequenza (SU) per monitorare la criochirurgia epatica. Questi tentativi si basano sul concetto che anche modeste variazioni di temperatura sono note per alterare in modo efficace la velocità di trasmissione del suono attraverso qualsiasi mezzo.
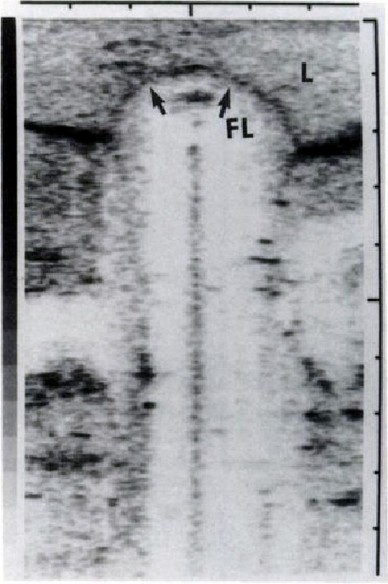
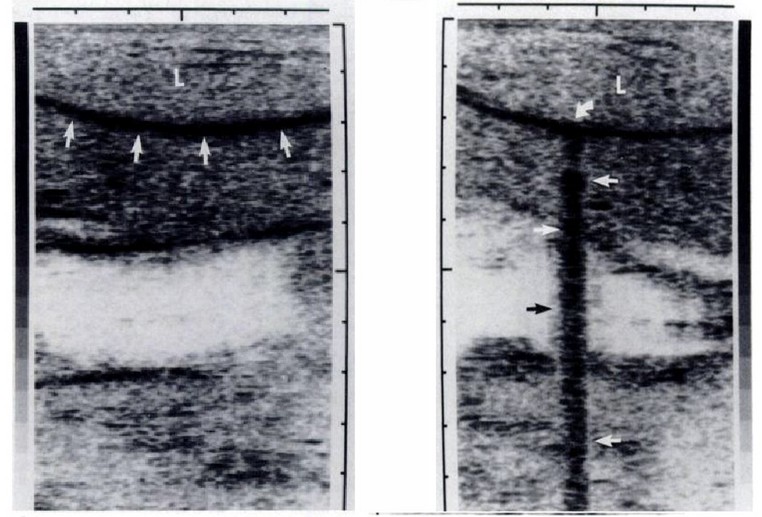
Le immagini dovute al monitoraggio con ultrasuoni del fegato sono molto eloquenti e rivelano la facilità di una comprensione e di conseguenza l’utilità che il chirurgo può trarne in sala operatoria.
Il dott. Onik, come abbiamo prima detto, nel 1988 esordì con una seconda importante pubblicazione che trattava l’uso degli ultrasuoni (US) per monitorare tessuti prostatici. Detta pubblicazione aveva il seguente titolo: " US characteristics of frozen prostate ". ( Caratteristica degli ultrasuoni (US) della prostata congelata).[53] In questo lavoro l’insigne medico ricordava che la criochirurgia è già stata utilizzata con successo per il trattamento del carcinoma prostatico. Commentava, però, l’impossibilità di monitorarne il congelamento ha portato a complicazioni locali che ne hanno limitano l'uso. La monitorizzazione del processo di congelamento su animali è stata realizzata in tempo reale utilizzando gli ultrasuoni al fine di favorire gli inconvenienti sopra menzionati. Il margine del tessuto congelato è apparso come un cerchio iperecogeno con un cono d'ombra acustico posteriore. Le criolesioni scongelate hanno evidenziato un’ecogenicità marcatamente ridotta rispetto a quelle normali della prostata non gelata. Questi cambiamenti caratteristici dovrebbero consentire l'applicazione più sicura e più efficace della criochirurgia prostatica.
Onik et al. hanno dimostrato la fattibilità del monitoraggio con ultrasuoni in tempo reale (US) del volume del tessuto ghiacciato. Questa tecnica è stata utilizzata per monitorare la criochirurgia del fegato.
Miglioramenti nella transrettale US (a ultrasuoni) e la possibilità di visualizzare i tumori prostatici anche di piccole dimensioni, con US (ultrasuoni), insieme con la capacità degli US (ultrasuoni) di evidenziare il congelamento, hanno dato la possibilità di monitorare la criochirurgia prostatica transrettale con gli US, concedendo al chirurgo i vantaggi della criochirurgia senza le sue complicazioni locali.
L'obiettivo di queste ricerche è stato quello di visualizzare l'aspetto del freddo e del disgelo del tessuto prostatico con gli US. L’obiettivo è stato raggiunto permettendo di sviluppare nuove tecniche di criochirurgia per il trattamento del carcinoma prostatico [54,55].
CRIOCHIRURGIA ANNI 90
Gli anni ’90 incominciano con una grande evoluzione della criochirurgia. Gli studi del Dott. Onik e dei suoi collaboratori hanno aperto nuove visioni e interessanti prospettive sull’uso della criochirurgia che rimane ancora oggi. Facciamo notare che in questo decennio, che precede il secolo 2000, nasce un fattivo interesse verso la simulazione matematica del processo di raffreddamento dei tessuti biologici e pari passo si osserva uno sviluppo della strumentazione meccanico-elettronica delle macchine preposte alla criochirurgia.
Facciamo notare che in questo decennio, che precede il secolo 2000, nasce un fattivo interesse verso la simulazione matematica del processo di raffreddamento dei tessuti biologici e pari passo si osserva uno sviluppo della strumentazione meccanico-elettronica delle macchine preposte alla criochirurgia.
La criochirurgia cattura maggiormente l’interesse dei fisici e degli ingegneri che con i matematici e i medici incominciano a esplorare nuove frontiere. Non è solo l’aspetto biologico ma anche quello fisico strumentale che cattura l’attenzione degli atenei e dei centri di ricerca mondiale.
In questi anni avviene una rivoluzione simile a quella che crearono Cooper e Lee negli anni ’60.
Nel frattempo sorgono scuole di ricercatori nel mondo accademico della Cina e del Giappone mentre le Università Statunitensi ed Israeliane partoriscono geniali idee e nuovi strumenti.
Un esempio di questo risveglio scientifico lo offre il prof Yoed Rabin del dipartimento di Ingegneria meccanica dell’istituto di tecnologie Tecnion-Israel di Haifa pubblicando una ricerca dal titolo: "Un Nuovo dispositivo di guida criochirurgica per il congelamento controllato" nel 1996 [60].
In questo lavoro i ricercatori YOED RABIN AND AVRAHAM SHITZER presentano un nuovo dispositivo criochirurgico utilizzante azoto liquido, che è una modifica di un sistema commerciale esistente.
Detto dispositivo è munito di una nuova guida che controlla con un computer la temperatura della sonda criogenica per mezzo di un elemento di riscaldamento elettrico.
L’attività scientifica mondiale è, in questa soglia di secolo, rivolta a determinare con tutti i mezzi a disposizione le condizioni migliori e le tecniche più efficaci per affrontare e migliorare la criochirurgia.
Molti studi e ricerche passate sono riprese e riviste in luce delle scoperte scientifiche e tecnologiche più moderne.
Questo processo d’innovazione, patrimonio dell’umanità, è tuttora in corso e sarà nostro compito tratteggiarne gli aspetti e descriverne le caratteristiche.
In Europa esiste già da alcuni anni una macchina criochirurgica tedesca. Erbocrio. (Fig. O)
Le caratteristiche di questo strumento chirurgico sono molto interessanti perché sono progettate per operare con sei sonde contemporaneamente. Ciò permette di operare tumori di grosse dimensioni in una sola applicazione chirurgica. Il tempo d’intervento è ridotto con evidenti vantaggi di costi e di salute per il paziente.
In questa macchina le sonde sono sterilizzabili e pertanto possono essere nuovamente utilizzabili per interventi futuri.
La temperatura di ognuna delle sei sonde può essere impostata e selezionata a piacimento del chirurgo.
Le temperature di ogni criodo e del tessuto sono visualizzate sul pannello tramite termocoppie. Tutto ciò permette il corretto posizionamento degli aghi sotto controllo degli ultrasuoni.
Questa macchina funziona con azoto liquido che è incamerato in un serbatoio e controllato strumentalmente.
I progettisti tedeschi fanno rilevare che, come abbiamo sopra accennato, il posizionamento delle criosonde e il loro processo di raffreddamento durante l’intervento possono essere monitorati con rilevatori a ultrasuoni.
INIZIO ANNI 2000
Sorgono pertanto collaborazioni scientifiche tra università statunitensi e asiatiche, si vengono a creare nuove scuole che sono indubbiamente portatrici di nuove idee e stimoli positivi.
Presentiamo quindi un eccellente lavoro dal titolo: “Simulazione Numerica per il trasferimento di calore nella criochirurgia del Cancro alla prostata” per opera di Jiayao Zhang, Jayathi Y. Murthy e Lisa X. Xu.( West Lafayette Shanghai).
In questo lavoro è presentato un quadro generale di calcolo per simulare il trasferimento di calore durante il processo di congelamento nel carcinoma della prostata criochirurgia.
I ricercatori evidenziano i vantaggi della criochirurgia in rapporto alle altre tecniche operatorie. Riconoscono che è minimamente invasiva e che richiede basse esigenze di ospedalizzazione, comporta un rischio ridotto di lesioni al tessuto normale e di complicazioni. E, fatto molto importante, non è “dose limitata” nel senso che può essere eseguita più volte per casi ricorrenti [54].
Un catetere uretrale per il riscaldamento, (indicato anche come riscaldamento uretrale), è inserito nell'uretra per proteggerla dal gelo. Questa procedura, che è stata introdotta da Onik [55], ha raggiunto un'efficacia paragonabile o superiore alle terapie tradizionali nel trattamento del cancro alla prostata [57,59,58]. Tra molti vantaggi, tuttavia, esistono delle limitazioni che compromettono la diffusione delle sue applicazioni e il conseguente successo. I segnali a ultrasuoni sono quasi completamente riflessi dall'interfaccia di congelamento per cui le ombre acustiche sono presenti sul fronte distale di ghiaccio.
Inoltre, le temperature del tessuto all'interno dell’iceball (sfera di ghiaccio) sono sconosciute, poiché l’interno non può essere monitorato da ultrasuoni. Questo è un grave inconveniente perché congelare semplicemente l'intera prostata non fornisce necessariamente un’ablazione adeguata.
I ricercatori ritengono che la simulazione numerica fornisca un potente strumento per gestire le complesse geometrie e le varie condizioni al contorno.
E’ con queste espressioni che gli studiosi giustificano le loro scelte e definiscono il loro obiettivo nel costruire un quadro globale di calcolo per simulare numericamente l’evoluzione della temperatura durante il processo di congelamento nel carcinoma della prostata criochirurgia.
In questo quadro, il calcolo della variazione di fase è stato realizzato da una tecnica di scambio di entalpia in cui è incorporato il calore latente. La geometria computazionale è stata costruita in conformità a immagini MRI di una prostata reale, e le condizioni al contorno sono state tarate con riferimento a superfici delle criosonde commercialmente disponibili e utilizzati gli uretrali caldi.
Incorporando il modello geometrico e dei confini, sono state eseguite le simulazioni numeriche del processo criochirurgico vero e proprio. Questo ha permesso la visualizzazione di qualsiasi isoterma selezionata nella prostata durante la criochirurgia e aiutato, in prospettiva, i medici a pianificare oggettivamente la procedura criochirurgica su base individuale.
La mappatura in tempo reale della temperatura richiederebbe computazionalmente programmi più efficienti e personalizzati dell’evoluzione termica.
Gli autori prospettano che una mesh ottimizzata anche con maglie grossolane dovrebbe sostanzialmente accelerare la simulazione.
Un’altra osservazione è che la validazione sperimentale in vivo dei risultati della simulazione è molto importante e può essere aiutata da tecniche di “imaging” avanzate. Gli autori, con senso premonitore, prevedono l’esigenza della creazione di un solutore numerico computazionalmente efficiente che deve essere trovato per applicare praticamente l'ottimizzazione per la prostata criochirurgia.
In quegli anni il Prof Lee e collaboratori pubblicano una relazione il cui titolo molto significativo è: “CRIOCHIRURGIA DEL CANCRO PROSTATICO: MIGLIORAMENTO DELL’ABLAZIONE GHIANDOLARE UTILIZZANDO DA 6 AD 8 CRIODI”. Abbiamo parlato, nel capitolo che tratta la biologia del freddo all’importanza scientifica e biologica di questo lavoro e ne abbiamo evidenziata l’importanza di base.
I ricercatori informano che nell’Aprile del 1996, un metodo criochirurgico aggiornato fu utilizzato usando da sei a otto criodi, e nel Giugno del 1997 furono trattati ottantuno uomini. Questo gruppo fu confrontato retrospettivamente con gli ultimi ottantadue casi fatti prima dell’Aprile del 1996 utilizzando cinque criosonde. Per garantire l’omogeneità dei gruppi, il confronto fu rapportato allo specifico antigene prostatico (PSA), a valori clinici, e segno Glison. Sei mesi dopo il trattamento criochirurgico, PSA e valori epiteliali residui furono messi a confronto tra i due gruppi.
Le conclusioni furono che un metodo riaggiornato che utilizza da sei a otto sonde ha dimostrato di essere effettivamente più efficace nell’ablazione ghiandolare che il metodo tradizionale a cinque sonde. E’ stato utilizzato senza alcuna difficoltà, esso possiede un ampio margine di sicurezza, e perfino tempi più corti di apprendimento. Queste innovazioni hanno consentito un miglior approccio all’obiettivo di una completa distruzione ghiandolare.
Nell’anno 2006 un’interessante pubblicazione francese riguardante un intervento sul fegato e dal titolo: “Ablazione Criochirurgica Transpleurodiafragmatica per metastasi epatiche colorettali ricorrenti non resecabili “ per opera di MATTIA STELLA, et al. prospetta l’interesse della scuola di Lyone nei riguardi della criochirurgia [70].
In questo lavoro è descritta la tecnica di ablazione criochirurgia (CSA) che permette la distruzione focale delle metastasi epatiche non resecabili dopo resezione precedente.
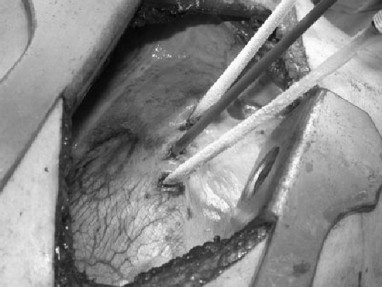
La figura P, sopra esposta chiarisce in modo evidente la posizione dei tre criodi e il tema generale dell’intervento.
Le conclusioni dei ricercatori francesi riguardo all’alto tasso di recidiva del tumore e dei risultati di sopravvivenza sono diretta conseguenza della gravità della malattia e dei trattamenti che i pazienti hanno subito in precedenza. Tuttavia, ripetono gli scienziati francesi, la recidiva di fatto non accade riguardo alle metastasi trattate con CSA.
Pertanto, terminano i ricercatori, la CSA transpleurodiafragmatica è sicura ed è associata con esito favorevole in pazienti molto selezionati con metastasi epatiche non operabili ricorrenti da cancro del colon-retto.
Nell’anno 2006 esce una pubblicazione del Dottor Scala et al., responsabile della chirurgia rigenerativa presso il Dipartimento di Terapie Chirurgiche Integrate dell’Istituto Nazionale per la Ricerca sul Cancro di Genova (Italia) [65], nella quale è descritto un intervento di criochirurgia su una paziente di 101 anni, affetta da avanzato melanoma maligno della pelle del viso riuscito con successo (nessuna recidiva a due anni dal trattamento criochirurgico).
In quest’articolo il Dottor Scala, informa che il trattamento è stato eseguito per mezzo di applicazioni criochirurgiche seriali (cicli di gelo e disgelo ripetuti) che sono state eseguite entro tre mesi; informa, inoltre, che la maggior parte della lesione fu trattata con una criosonda ad azoto liquido (-196°C) inizialmente, mentre la rimanente parte malata fu utilizzata una criosonda raffreddata a protossido d’azoto (-89,5°C). Lo studioso faceva notare che l’intervento utilizzante l’azoto liquido può congelare sostanzialmente in maggior profondità mentre la capacità di congelamento del protossido d’azoto è limitata a una profondità di circa cinque millimetri. Così, un adeguato trattamento delle lesioni ingombranti richiederebbe due strumenti criogenici: uno con liquido d’azoto per i tumori ingombranti, a causa della più pronunciata alimentazione vascolare e quindi per ottenere una maggiore profondità d’infiltrazione nei tessuti circostanti e il protossido d’azoto per la residua malattia superficiale.
Un’altra osservazione interessante dello studioso consiste nel consigliare una maggiore aggressività al tumore nel produrre una “palla di ghiaccio” includente almeno 5 mm di tessuto apparentemente normale che circonda il tumore primario.
Presenteremo in un prossimo capitolo una serie d’interventi criochirurgici su tumori della pelle corredati di dettagli e immagini specifiche di detti interventi effettuati dal Dott. Scala.
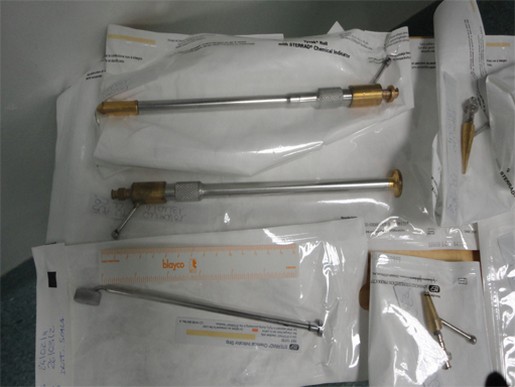
Ci limitiamo pertanto a far vedere alcuni elementi dei criodi che il chirurgo italiano utilizza nei suoi interventi. (Fig. Q )
Il dottor M. Scala presenta osservazioni anticipano le future esigenze chirurgiche cui le prossime macchine dovranno rispondere. Egli auspica per primo una regolarità di funzionamento che deve poter permettere la variabilità della profondità del fronte criogenico; per secondo l’esigenza di una “simulazione” matematica che possa informare in anticipo il chirurgo riguardo agli effetti del fronte prodotto. In altre parole, l’intervento “simulato o virtuale”.
Tra il risveglio definitivo della criochirurgia e il generale interessamento a essa dei vari chirurghi del mondo presentiamo un efficace studio di applicazione della criochirurgia al disturbo molto doloroso del piede: la fascite.
I dottori Brian H. Allen, Lawrence M. Fallat, e Steve M. Schwartz hanno pubblicato un articolo dal titolo “La criochirurgia: una tecnica innovativa per il trattamento della fascite plantare”. Sono gli anni del 2007 e quasi in tutte le più rinomate università del mondo si studia e si applica la criochirurgia. In questo studio prospettico il cui obiettivo è testare l'efficacia della criochirurgia sulla dolorosa fascite plantare del tallone. La fascite plantare è un problema comune del piede visto spesso da una varietà di specialità mediche.
Sono stati trattati cinquantanove pazienti (61 talloni), che avevano fallito la terapia conservativa e sono stati considerati candidati alla criochirurgia. I pazienti sono stati valutati su una scala a 11 punti analogica visiva valutata prima dell'intervento e seguita fino a un anno di follow-up. Dove zero è assenza di dolore e 10 è lo stato di peggiore dolore che abbia mai avuto. Il dolore è stato valutato il giorno dell'intervento e in quelli successivi 1, 7, 28, 90, 180 e 365 dopo la procedura criochirurgia.
Il punteggio medio del dolore è stato 8.38, accertato prima della criochirurgia al giorno zero, è statisticamente indicativo come riferimento per la valutazione del dolore medio, pari a 1.26 a 365 giorni dopo l'intervento.
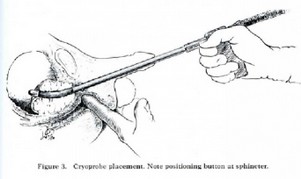
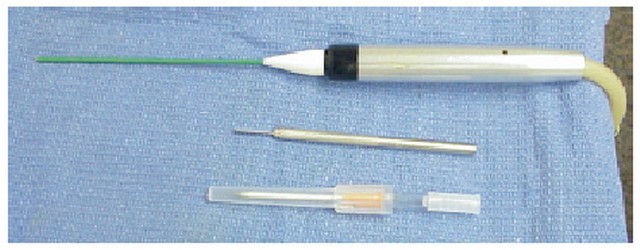
La denervazione percutanea è stata somministrata a 61 tacchi che coinvolgono 59 pazienti con strumentazione della Cryotech Corporation (Atlanta, GA) (Fig. R e S) in uno studio ambulatoriale.
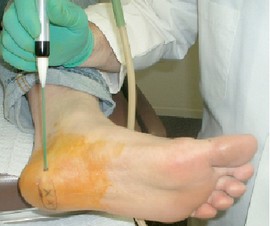
Prima della procedura, l'area di tenerezza massima è stata accuratamente identificata (Fig. S). Il luogo più comune per questa tenerezza palpabile era lungo la banda mediale della fascia plantare origine in prossimità del tubercolo calcaneare [56].
 Questi risultati suggeriscono che la criochirurgia è significativamente efficace nel trattamento di pazienti con fascite plantare recalcitrante. La criochirurgia offre un modo di trattamento molto efficace dopo fallimento del processo conservativo senza ricorrere alla chirurgia aperta invasiva ambulatoriale. Inoltre, criochirurgia per il trattamento di fascite plantare include un periodo minimo di recupero con meno complicazioni. Il risultato finale sembra essere simile a qualsiasi correzione chirurgica con minima o nessuna disabilità e senza le spese supplementari mediche. Un confronto diretto di chirurgia ambulatoriale rispetto alla criochirurgia potrebbe rivelarsi prezioso.
Questi risultati suggeriscono che la criochirurgia è significativamente efficace nel trattamento di pazienti con fascite plantare recalcitrante. La criochirurgia offre un modo di trattamento molto efficace dopo fallimento del processo conservativo senza ricorrere alla chirurgia aperta invasiva ambulatoriale. Inoltre, criochirurgia per il trattamento di fascite plantare include un periodo minimo di recupero con meno complicazioni. Il risultato finale sembra essere simile a qualsiasi correzione chirurgica con minima o nessuna disabilità e senza le spese supplementari mediche. Un confronto diretto di chirurgia ambulatoriale rispetto alla criochirurgia potrebbe rivelarsi prezioso.
Come abbiamo in precedenza affermato la criochirurgia, anche se con limitazioni particolari, alla fine degli anni 2010, è stata applicata in molte parti del mondo (e con successo).
Vediamo, appunto, che chirurghi norvegesi, utilizzanti attrezzature costruite sempre nell’Europa settentrionale, si sono cimentati negli interventi di criochirurgia prostatica.
Nel 2007 il dottor Bjerklund Johansen TE dell’Urology section, Telemark Hospital, Porsgrunn, Norway ha presentato un lavoro descrivente un intervento di criochirurgia prostatica [61].
L’obiettivo di questo lavoro è stato presentare l’esperienza preliminare con la CSA (ablazione prostatica crioterapia) in cancri della prostata in un centro della Norvegia.
L’equipe di ecografia fu un B&K Falkon 2101 con una sonda 8658 (B6K Danese) un braquistand con pedale e un braqui standoff nella sonda (Fig. T). Il braqui standoff era un lenzuolo di plastica collocato intorno alla sonda con una finestra per l’espansione del collettore interno quando si scalda con acqua. Per congelare utilizzarono gas Argon ed Elio.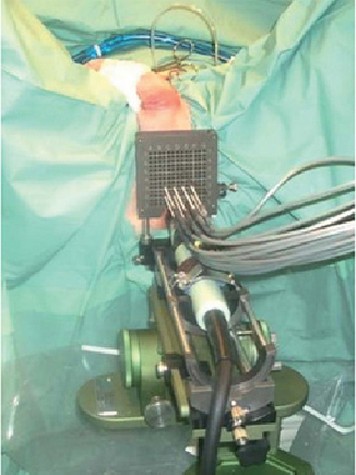
La maggior parte degli interventi fu realizzata con anestesia epidurale o generale in modo che il paziente non si potesse muovere. Il trattamento di CSA, includendo l’inserzione degli aghi e del loro periodo di congelamento e riscaldamento, fu realizzato come descritto prima e in accordo con le guide cliniche dell’Associazione Europea di Urologia (EAU) del cancro della prostata [63].
Il chirurgo norvegese afferma, dopo gli interventi criochirurgici e le opportune analisi statistiche, che la CSA è riconosciuta dall’EAU, ora, come una valida scelta terapeutica per il trattamento del cancro prostatico. Conferma che molte istituzioni offrono la CSA solo a pazienti anziani a causa della mancanza di risultati a lungo termine e che se i risultati a lungo termine confermeranno quelli ottenuti entro poco tempo, la CSA potrebbe essere offerta come un trattamento primario anche a pazienti giovani.
Nell’anno 2011 è stato pubblicato un articolo il cui titolo, molto significativo “Cryotherapy for barrett’s Esophagus: Who, How, and Why?” (Crioterapia per l’esofago di Barrett: chi, come e perché?) che pone in evidenza la necessità di comprendere le tematiche del cancro all’esofago a proposito della criochirurgia.
Detto articolo è stato scritto dal Dott. Ann Chen e dal Dott. P. Jay Pasricha che è un inventore del dispositivo Polar crioablazione Wand (Gl alimentazione, Camp Hill, Pennsylvania, che presenteremo nel seguito) e consulente per l’azienda.
Questi ricercatori della Divisione di Gastroenterologia ed Epatologia, Stanford University School of Medicine, Stanford University Medical Center, Redwood City, Stati Uniti d’America presentano le difficoltà e i vantaggi di una criochirurgia particolare: quella esofagea.
E’ necessario ricordare che a circa 16.500 americani è stato diagnosticato un cancro esofageo e 14.500 di essi muore per questa neoplasia ogni anno [68]. L’incidenza di adenocarcinoma esofageo è continuata a crescere drammaticamente nel corso degli ultimi quattro decenni e sta crescendo a un ritmo superiore di ogni altro cancro negli Stati Uniti. L’esofago di Barrett (BE) è un noto fattore di rischio nello sviluppo di adenocarcinoma esofageo.
Con la presenza di displasia di alto grado (HGD), tuttavia, il rischio di progressione verso il cancro può essere del valore del 10% per paziente-anno. Tradizionalmente, la chirurgia con esofagectomia è stata il cardine del trattamento per i pazienti con HDG, tuttavia, molti di questi sono anziani, e ritenuti poveri candidati alla chirurgia. L’esofagectomia, inoltre, è associata a un’indicativa mortalità e morbilità e le relazioni recenti hanno mostrato recidiva di metaplasia di Barrett nel 18% dei pazienti dopo esofagectomia “curativa”, nonostante alte dosi medicative di acido soppressivo [69].
DISPOSITIVI della CRIOTERAPIA ENDOSCOPICA
Da quanto abbiamo avuto modo di verificare lo sviluppo delle "tecniche del freddo" ha costantemente seguito il progresso tecnologico che è legato alle scoperte scientifiche e tecnologiche.
L’evoluzione della fisica della medicina e dell’ingegneria viaggia di pari passo e, come vedremo nel prossino capitolo, una è legata all’altra.
Un ultimo esempio di come le esperienze passate sia diventato patrimonio della chirurgia attuale, presentiamo una serie d’interventi che testimoniano la giusta visione del Dott. Fay nei riguardi di questa tecnica che riscuote ancora oggi grandi successi ed è in un continuo progresso chirurgico e tecnologico.
L’ipotermia già introdotta dal Dott. Fay nel 1938 si è sviluppata ed ha affinato le tecniche chirurgiche e la strumentazione criogenica.
Alla fine degli anni 2010 in tutto il mondo è praticata con successo su soggetti giovani e no.
Nel 2010 i Dottori Gunasekaran G, Bencsath K, Hupertz V, Fung JJ, Pettersson G, Miller C. della Cleveland Clinic Foundation, Cleveland USA registrano un intervento d’ipotermia profonda con arresto circolatorio su di un bambino per aiutare la gestione della stenosi della vena cava come conseguenza di un intervento epatico. I risultati sono stati soddisfacenti [71].
L’anno seguente un’equipe russa guidata dal Dottor Kazanskaia GM et al. descrivono i vantaggi dell’ipotermia applicata a bambini con la malattia di Roger e la diminuzione dei rischi connessi. [72]
Nel 2011 molte Università internazionali quali l’Irlanda del Nord con un articolo scritto dai Dottori Parissis H, Hamid U, Soo A, Al-Alao B. trattanti sull’ipotermia sistematica per la protezione del sistema nervoso centrale durante l'intervento aortico rivela quesiti e dubbi su questo strumento [73]. Mentre i Dottori Krüger T, Weigang E, Hoffmann I, Blettner M, Aebert H, della GERAADA Investigators (GERMANIA) descrivono la protezione cerebrale durante l'intervento chirurgico per la dissezione aortica acuta di tipo A: risultati del Registro di sistema tedesco per il tipo di dissezione aortica [74]. Nello stesso anno Università della Malesia [75] del Belgio [76] presentano i loro lavori riguardo all’ipotermia evidenziandone gli innegabili vantaggi.
Nell’anno 2012 innumerevoli sono gli interventi effettuati nel mondo. Gli Stati Uniti si presentano con parecchi interventi aortici con arresto circolatorio ipotermico [77-81]. Anche dalla Grecia ci giunge, in quell’anno, una pubblicazione d’intervento aortico con arresto circolatorio ipotermico [82]. E due lavori dal Giappone, sempre sullo stesso tema [83,84], propongono una ricerca sul miglioramento del monitoraggio dei potenziali evocati durante l’intervento chirurgico dell’aorta toracica in ipotermia [85].
In Italia dall’Università di Bologna il prof Pacini D. et al. presenta una pubblicazione dal titolo "perfusione cerebrale anterograda selettiva e chirurgia ipotermica moderata dell'arco aortico: esiti clinici nei pazienti anziani" [86].
A pochi mesi di distanza dalla Cina è presentato un lavoro sperimentale su di un coniglio studiandone la protezione cerebrale in arresto circolatorio [87] mentre i professori Ji B, Liu J, Wang X, Long C, cinesi, si cimentano con il tema della sicurezza [88]. Lo stesso tema è proposto dall’equipe tedesca dei professori Zierer A, Moritz A. i quali indagano sulla protezione cerebrale per la chirurgia dell'arco aortico adottando una lieve ipotermia selettiva con perfusione cerebrale [89]. Nel 2012 a Siena in Toscana (Italia) è stato realizzato un intervento su di un bambino la cui temperatura corporale è stata abbassata a 18 gradi centigradi.
I chirurghi dell’Ospedale delle Scotte a Siena hanno fermato il suo cuore per 15 minuti ed hanno avviato l’intervento per togliere un grosso aneurisma dal suo cervello.
Il bambino dopo una breve permanenza in Terapia Intensiva Neurochirurgia, è ricoverato in Neurochirurgia Pediatrica, sta bene.
BIBLIOGRAFIA |
|
1 |
Schreuder HWB, ed.The cryosurgical treatment of benign and low-grade malignant bone tumors. Wageningen, The Netherlands: Ponsen&Looijen; 1997:7–11 |
2 |
Breasted JH. The Edwin Smith surgical papyrus. Vol III. Chicago: University of Chicago, Oriental Institute Publications; 1930:72–73 |
3 |
Dawber RPR. Cold kills! Clin Exp Dermatol 1988;13:137–150. |
4 |
Davison MHA. The evolution of anesthesia. Br J Anaesth 1959;31:134–137 |
5 |
Larrey DJ. Surgical memoirs of campaigns of Russia, Germany and France.Translation by JCMercer. Philadelphia: Carey and Lea; 1832:7–11 |
6 |
Gage AA. History of cryosurgery. Semin Surg Oncol 1998;14: 99–109 |
7 |
Arnott J: Practical illustrations of the remedial efficacy of a verylow or anaesthetic temperature. I. In cancer. Lancet 1850; 2: 257–259 |
8 |
Bird HM: James Arnott, M.D. (Aberdeen) 1797-1883: a pioneer in refrigeration analgesia. Anaesthesia 1949; 4:10–17 |
9 |
White AC: Liquid air: its application in medicine and surgery. Med Rec 1899; 56:109–112 |
10 |
Pusey WA: The use of carbon dioxide snow in the treatment of nevi and other lesions of the skin. J Am Med Assoc 1907; 49:1354–1356. (da eliminare uguale a 18) |
11 |
Torre D, Lubritz RR, Kuflik EG. Practical cutaneous cryosurgery. Norwalk, CT: Appleton & Lange, 1988. |
12 |
Sealy WC, Brown IW Jr, YoungWGJr (1958)A report on the use of both extracorporeal circulation and hypothermia for open heart surgery. Ann Surg 147: 603–613 |
13 |
Solomon RA, Smith CR, Raps EC, Young WL, Stone JG, Fink ME (1991) Deep hypothermic circulatory arrest for the management for complex anterior and posterior circulation aneurysms. Neurosurgery 29: 732–737 |
14 |
Spetzler RF, Hadley MN, Rigamonti D, Carter LP, Raudzens PA, Shedd SA, Wilkinson E (1988) Aneurysms of the basilar artery treated with circulatory arrest, hypothermia, and barbiturate cerebral protection. J Neurosurg 68: 868–879 |
15 |
Wolf JM. Temple Fay, M.D.—Inquisitive scientist, prolific scrivener. Pathol Med J 1965;68:47—51. |
16 |
Fay T (1959) Early experiences with local and generalized refrigeration of the human brain. J Neurosurg 16: 239–260. |
17 |
Zacarian SA, Adham MI: Cryotherapy of cutaneous malignancy. Cryobiology 1966; 2:212–218. |
18 |
Cooper IS, Lee A: Cryostatic congelation: a system for producing a limited controlled region of cooling freezing of biologic tissues. J Nerv Ment Dis 1961; 133:259–263. |
19 |
Yantomo C, Soanes WA, Gonder MJ, Shulman S: Studies in cryoimmunology. I. The production of antibodies to urogenital tissue in consequence of freezing treatment. Immunology 1967; 12:395–410. |
20 |
Gonder MJ, SoanesWA, Smith V. Chemical and morphologic changes in the prostate following extreme cooling. Ann NY Acad Sci 1965;125:716–729 |
21 |
Ortved WE, O’Kelly FM, Todd IA, et al: Cryosurgical prostatectomy: a report of 100 cases. Br J Urol 1967; 39:577–583. |
22 |
Jordan WP Jr, Walter D, Miller GH Jr, Drylie D: Cryotherapy of benign and neoplastic tumors of the prostate. Surg Gynecol Obstet 1967; 125:1265–1268. |
23 |
Dowd, JB, Flint LD, Zinman LN, Tripathi VN: Experiences with cryosurgery of the prostate in the poor-risk patient. Surg Clin North Am 1968; 48; 627–632. |
24 |
Rouvalis P: Cryosurgery of the prostate under local anesthesia. J Urol 1969; 102:244–245. |
25 |
Flocks RH, Nelson CM, Boatman DL: Perineal cryosurgery for prostatic carcinoma. J Urol 1972; 108:933–935. |
26 |
Torre D: Alternate cryogens for cryosurgery. J Dermatol Surg 1975; 1:56–58 |
27 |
Soanes, W.A., Gonder, M. J. and Ablin, R. J. : Immuno-cryothermic response. Read at annual meeting of Society of Cryosurgery, Miami Beach, Florida, January 12-17, 1969. |
28 |
Stellar S: Intracranial cryosurgery in a canine model: a pilot study [1etter]. Surg Neurol 1993; 39:331–332. |
29 |
Conway LW: Stereotaxic diagnosis and treatment of intracranial tumors including an initial experience with cryosurgery for pinealomas. J Neurosurg 1973; 38; 453–460. |
30 |
Walder HA: Experimental cryosurgery. In von Leden H, Cahan WG (eds): “Cryogenics in surgery’’ Flushing, NY: Medical Examination Publishing; 1971. p. 150–181. |
31 |
Soanes WA, Ablin RJ, Gonder MJ: Remission of metastatic lesions following cryosurgery in prostatic cancer: immunologic considerations. J Urol 1970; 104:154–159. |
32 |
Gursel E, Roberts M, Veenema R: Regression of prostate cancer following sequential cryotherapy to the prostate. J Urol 1972; 108:928–932. |
33 |
Gage AA: Cryosurgery for difficult problems in cutaneous cancer. Cutis 1975; l6:465–470. |
34 |
Zacarian SA (ed): “Cryosurgical advances in dermatology and tumors of the head and neck. Springfield, IL: Charles C. Thomas; 1977. |
35 |
Torre D, Lubritz R, Graham G: Cryosurgical treatment of basal cell carcinomas. Prog Dermatol 1978; 12:11–16. |
36 |
Shields JA, Parsons H, Shields CL, Gibson ME: The role of cryotherapy in the management of retinoblastoma. Am J Ophthalmol 1989; 108:260–264. |
37 |
Jakobiec FA, Rini FJ, Fraunfelder FT, Brownstein S: Cryotherapy for conjunctival primary acquired melanosis and malignant melanoma. Experience with 62 cases. Ophthalmology 1988; 95:1058–1070. |
38 |
Townsend DE, Richart RM: Cryotherapy and carbon dioxide laser management of cervical intraepithelial neoplasia: a controlled comparison. Obstet Gynecol 1983; 61:75–78. |
39 |
Creasman WT, Hinshaw WM, Clarke-Pearson DL: Cryosurgery in the management of cervical intraepithelial neoplasia. Obstet Gynecol 1984; 63:145–149. |
40 |
Ferenczy A: Comparison of cryo- and carbon dioxide laser therapy for cervical intraepithelial neoplasia. Obstet Gynecol 1985; 66:793–798. |
41 |
Benedet JL, Miller DM, Nickerson KG, Anderson GH: The results of cryosurgical treatment of cervical intraepithelial neoplasia at one, five, and ten years. Am J Obstet Gynecol 1987; 157:268–273. |
42 |
Andersen ES, Thorup K, Larsen G: The results of cryosurgery for cervical intraepithelial neoplasia. Gynecol Oncol 1988:30:21–25. |
43 |
Sumida S, Okuyama Y, Kamegai T. Serum hepatitis from frozen blood. Lancet 1967;II:1255–1256. |
44 |
Sumida S, Sumida M, Miyata K, et al. Frozen blood: HLA sensitization. Low Temp Med 1975;1:227–231. |
45 |
Sumida S, Eto S, Yamaguchi A, Kawata H. Fibrillation and contraction tracings from adult rat hearts after freezing in liquid nitrogen for ten years. Low Temp Med 1984;10:47–51. |
46 |
Sumida S, Xi Y, Oshikawa K. How long can we cryopreserve stem cells of cancer patients? Cryobiology 1997;35:334. |
47 |
Sumida S. Terminology of low temperature in medicine and cryobiology. Low Temp Med 2002;28:49–50. |
48 |
Sumida S. Transfusion of blood preserved by freezing. Stuttgart: Lippincott-Geroge Thieme; 1973:8–21. |
49 |
Sumida S, Ebine K,Tamura S, Lee M. Viability of supercooled hearts for transplantation. Cryobiology 1987;24:570–671. |
50 |
Bonney WW, Fallon B, Gerber WL, et al: Cryosurgery in prostatic cancer: survival. Urology 1982; 19:37–42. |
51 |
Loening S, Lubaroff D: Cryosurgery and immunotherapy for prostatic cancer [Review]. Urol Clin North Am 1984; 11:327–336. |
52 |
Onik G, Gilbert J, Hoddick W, et al: Sonographic monitoring of hepatic cryosurgery in an experimental animal model. AJR Am J Roentgenol 1985; 144:1043–1047. |
53 |
Onik G, Cobb C, Cohen J, et al: US characteristics of frozen prostate. Radiology 1988; 168:629–631. |
54 |
Onik, G. M., 1995, “Prostate Cryoablation: A Reappraisal,” Percutaneous Prostate Cryoablation, G. M. Onik, B. Rubinsky, G. Watson, R. J. Ablin, eds., Quality Medical Publishing, St. Louis, MO, Chap. 1. |
55 |
Onik, G., 1989, “Transperineal Prostatic Cryosurgery Under Transrectal Ultrasound Guidance,” Semin. Interventional Radiol., 6, pp. 90–96. |
56 |
Kinley S, Frascone S, Calderone D, Wertheimer SJ, Squire MA, Wiseman FA. Endoscopic plantar fasciotomy versus traditional heel spur surgery: a prospective study. J Foot Ankle Surg 32:595– 603, 1993. |
57 |
Balm DK, Lee F, Solomon MH, et al: Prostate cancer: US-guided percutaneous cryoablation. Radiology 1995; 194:551–556. |
58 |
Ghafa, M. A., Johnson, C. W., Taille, A. D. L., Benson, M. C., Bagiella, E., Fatal, M., Olsson, C. A., and Katz, A. E., 2001, “Salvage Cryotherapy Using an Argon Based System for Locally Recurrent Prostate Cancer after Radiation Therapy: The Columbia Experience,” J. Urol. [Baltimore], 166, pp. 1333–1338. |
59 |
Bahn, D. K., Lee, F., Badalament, R., Kumar, A., Greski, J., and Chernick, M., 2002, “Target Cryoablation of the Prostate: 7-Year Outcomes in the Primary Treatment of Prostate Cancer,” Urology, 60s2ad, pp. 3–11. |
60 |
Yoed Rabin, Avraham Shitzer. A new Cryosurgical Device for Controlled Freezing. Cryobiology 1996; 33: 82-92. |
61 |
Bjerklund Johansen TE. Crioterapia pròstatica como tratamiento primario en pacientes con càncer de prostata. Actas Urol Esp. 2007; 31(6): 651-659. |
62 |
Daigo Tanaka, Kenji Shimada, Michael R. Rossi, Yoed Rabin. Towards intra-operative computerized planning of prostate cryosurgery. International Journal of medical Robotics and Computer Assisted Surgery 2007; 3: 10-19. |
63 |
Cytron S, Greene D, Witsch UKF, Nylund P, Bjerklund Johansen TE. Cryoablation of the prostate: Technical recommendations. Accepted for publication as part of EAU guidelines on prostate cancer. European Association of Urology. Guidelines 2007 (ISBN-13:978-90-70244-59-0). |
64 |
Giovanni Giorgi, Leopoldo Avalle, Massimo Brignone, Michele Piana and Giacomo Caviglia. An optimization approach to multiprobe cryosurgery planning. Computer Methods in Biomechanics and Biomedical Engineering May 2011; 00: 1–14. |
65 |
Scala M., Gippone M., Queirolo P., et al. Cryosurgery for advanced malignant melanoma of the facial skin. A case of report. In Vivo 2006; 20: 153 – 156. |
66 |
H. Wang, W. Olivero, D. Wang, and G. Lanzino. History of Neurosurgery. Cold as a therapeutic agent. Acta Neurochir (Wien) 2006; 148: 565-570. |
67 |
Rubinsky B.. Cryosurgery. Ann. Rev. Biomed. Eng. 2000; 2: 157-187. |
68 |
American Cancer Society. Cancer facts and figures 2009. Atlanta (GA): American Cancer Society; 2009. |
69 |
Wolfsen HC, Hemminger LL, DeVault KR. Recurrent Barrett’s esophagus and adenocarcinoma after esophagectomy. BMC Gastroenterol 2004;4:18. |
70 |
Mattia Stella, François Mitieux, Pierre Meeus, Pierre kaemmerlen, Cyril Lafon, Michel Rivoire. Transpleurodiaphragmatic Cryosurgical Ablation for Recurrent Unresectable Colorectal Liver Metastases. Journal of Surgical Oncology 2006; 93: 268-272. |
71 |
Gunasekaran G, Bencsath K, Hupertz V, Fung JJ, Pettersson G, Miller C. Deep ypothermia with circulatory arrest to aid in the management of suprahepatic vena cava stenosis after liver transplantation. Liver Transpl. 2010 Dec;16(12):1434-6. doi: 10.1002/lt.22183. |
72 |
Kazanskaia GM, Volkov AM, D'iakonitsa TM, Karas'kova AM. [Ultrastructure of coronary microvessels in conditions of heart reperfusion following prolonged ischemia while applying various methods of artificial hypothermia]. Tsitologiia. 2011;53(12):968-77. |
73 |
Parissis H, Hamid U, Soo A, Al-Alao B. Brief review on systematic hypothermia for the protection of central nervous system during aortic arch surgery: a double-sword tool? J Cardiothorac Surg. 2011 Nov 20;6:153. doi: 10.1186/1749-8090-6-153. |
74 |
Krüger T, Weigang E, Hoffmann I, Blettner M, Aebert H. Circulation. Cerebral protection during surgery for acute aortic dissection type A: results of the German Registry for Acute Aortic Dissection Type A (GERAADA). 2011 Jul 26;124(4):434-43. |
75 |
Sachithanandan A, Badmanaban B. Re-do sternotomy for complex aortic surgery under deep hypothermic circulatory arrest: left ventricular vent--an invaluable adjunct. Interact Cardiovasc Thorac Surg. 2011 Apr;12(4):608. |
76 |
El Oumeiri B, Louagie Y, Buche M. Reoperation for ascending aorta false aneurysm using deep hypothermia and circulatory arrest. Interact Cardiovasc Thorac Surg. 2011 Apr;12(4):605-8. |
77 |
Khalpey Z, Dekkers RJ, Nauta FJ, Shekar P. Warm beating heart with deep hypothermic circulatory arrest: a technique for an unclampable aorta with aortic valve regurgitation. J Thorac Cardiovasc Surg. 2012 Sep;144(3):731-2. |
78 |
de Zélicourt D, Jung P, Horner M, Pekkan K, Kanter KR, Yoganathan AP. Cannulation strategy for aortic arch reconstruction using deep hypothermic circulatory arrest. Ann Thorac Surg. 2012 Aug;94(2):614-20. |
79 |
Corvera JS, Fehrenbacher JW. Open repair of chronic aortic dissections using deep hypothermia and circulatory arrest. Ann Thorac Surg. 2012 Jul;94(1):78-81; discussion 82-3. |
80 |
Mazzeffi M, Marotta M, Lin HM, Fischer G. Duration of deep hypothermia during aortic surgery and the risk of perioperative blood transfusion. Ann Card Anaesth. 2012 Oct-Dec;15(4):266-73. |
81 |
Di Luozzo G, Griepp RB Cerebral protection for aortic arch surgery: deep hypothermia. Semin Thorac Cardiovasc Surg. 2012 Summer;24(2):127-30. |
82 |
Perreas K, Samanidis G, Dimitriou S, Kalogris P, Balanika M, Antzaka C, Khoury M, Michalis A. Outcomes after ascending aorta and proximal aortic arch repair using deep hypothermic circulatory arrest with retrograde cerebral perfusion: analysis of 207 patients. Interact Cardiovasc Thorac Surg. 2012 Sep;15(3):456-61. |
83 |
Hata M, Akiyama K, Wakui S, Takasaka A, Shiono M. Concomitant aortic valve and ascending aorta replacement with moderate hypothermic circulatory arrest to treat an aortic bicuspid valve with post-stenotic dilatation. Surg Today. 2012 Sep;42(9):913-6. |
84 |
Hiraoka K, Kawatsu S, Mori E, Saiki Y. Total aortic arch replacement using hypothermic circulatory arrest with antegrade selective cerebral perfusion: are there cerebral deficits other than frank stroke?. Gen Thorac Cardiovasc Surg. 2012 Jun;60(6):345-9. |
85 |
Kawaguchi M, Kawamata M, Yamada Y. Improvement of motor evoked potentials monitoring is required during thoracic or thoracoabdominal aortic aneurysm surgery under hypothermic cardiopulmonary bypass. J Anesth. 2012 Apr;26(2):157-9. |
86 |
Pacini D, Di Marco L, Leone A, Di Bartolomeo R, Sodeck G, Englberger L, Carrel T, Czerny M. Antegrade selective cerebral perfusion and moderate hypothermia in aortic arch surgery: clinical outcomes in elderly patients. Eur J Cardiothorac Surg. 2012 Aug;42(2):249-53; discussion 253. |
87 |
Wang Q, Yang J, Long C, Zhao J, Li Y, Xue Q, Cheng L, Cheng W. Hyperoxia management during deep hypothermia for cerebral protection in circulatory arrest rabbit model. ASAIO J. 2012 Jul-Aug;58(4):330-6. |
88 |
Ji B, Liu J, Wang X, Long C. How much is safe: the flow of antegrade cerebral perfusion during deep hyperthermia circulatory arrest. Ann Thorac Surg. 2012 Feb;93(2):693-4. |
89 |
Zierer A, Moritz A. Cerebral protection for aortic arch surgery: mild hypothermia with selective cerebral perfusion. Semin Thorac Cardiovasc Surg. 2012 Summer;24(2):123-6. |